

О ботулинотерапии постинсультного спастического пареза рассказывает врач-невролог Андрей Королёв.
Спастический парез
Спастический парез, развившийся после мозгового инсульта, как правило, сохраняется в течение всей жизни больного. При этом развиваются вторичные изменения в мышцах, сухожилиях и суставах. В связи с этим актуальной является разработка подходов к лечебному воздействию на мышечную спастичность, в том числе с использованием инъекций ботулотоксина.

Андрей Анатольевич Королев, врач-невролог, кандидат медицинских наук, член ассоциации неврологов Санкт-Петербурга, Межрегиональной общественной организации специалистов ботулинотерапии
Спастический мышечный гипертонус характеризуется возникновением увеличивающегося сопротивления при первых быстрых пассивных движениях и затем внезапном уменьшении его — феномен “складного ножа” по Шеррингтону. В настоящее время под спастичностью понимают двигательное нарушение, являющееся частью синдрома поражения верхнего мотонейрона, характеризующееся скорость-зависимым повышением мышечного тонуса и сопровождающееся повышением сухожильных рефлексов в результате гипервозбудимости рецепторов растяжения.
Однажды развившись, спастический парез, как правило, сохраняется в течение всей жизни больного. При этом если спастичность сохраняется в течение длительного времени, развиваются вторичные изменения в мышцах, сухожилиях и суставах (фиброз, атрофия, контрактура). Лечение спастического пареза — пока практически неразрешимая задача. В связи с этим столь актуальной является разработка подходов к лечебному воздействию на мышечную спастичность, основанных на изучении механизмов ее развития.
Для коррекции мышечного гипертонуса нередко используют различные методы физиотерапии, лечебной физкультуры, рефлексотерапии, а также фармакологическое лечение в виде назначения миорелаксантов.
Препараты ботулинического нейротоксина типа А, как действенный метод лечения постинсультной статичности.
В последние годы при лечении постинсультной спастичности стали применяться препараты ботулинического нейротоксина типа А. Данный метод лечения предложен для освоения практикующим врачам сравнительно недавно, несмотря на то, что первое научное сообщение о применении блокад ботулотоксина появилось в печати более 20 лет назад.
В сравнении с имеющимися методами лечения мышечного гипертонуса, локальное введение ботулотоксина имеет ряд несомненных преимуществ. Во-первых, лечение хорошо переносится и не связано с риском серьезных осложнений. Во-вторых, возможен выбор одной или нескольких мышц для инъекции и подбор дозы препарата, обеспечивающей желаемую степень расслабления.
Механизм действия ботулотоксина
Как известно, ботулизм — тяжелое инфекционное заболевание, проявляющееся периферическими параличами мышц и вегетативными расстройствами вследствие нарушения периферической холинергической медиации, вызываемого ботулиническим нейротоксином. В настоящее время известны 8 серологических подтипов ботулотоксина: А, В, С1, С2, D, E, F, G. Ботулизм у человека могут вызвать серотипы А, В, Е, F, G, но самым сильнодействующим является тип А.
Как в своей природной форме, так и в виде лекарства ботулотоксин представляет смесь различных белков. Основные составные их части — нейротоксин и нетоксичные протеины. Нейротоксин состоит из двух полипептидных цепей (легкой — массой 50 кДа и тяжелой — массой 100 кДа), соединенных одной дисульфидной группой и одним атомом цинка. Такая структура молекулы нейротоксина обусловливает лабильность ее конформации и неустойчивость к действию механических, физических и химических факторов, приводящих к потере биологической активности. В своей лекарственной форме нейротоксиновые цепи окружены и стабилизированы крупными пептидными молекулами гемагглютининов и нетоксичных негемагглютининовых протеинов. Большая молекулярная масса нетоксичной части комплекса (730 кДа) препятствует как расщеплению нейротоксина, так и быстрой диффузии его в окружающие ткани, обеспечивая тем самым локальность воздействия. Однако присутствие белковых молекул является фактором, способствующим образованию нейтрализующих антител ко всему нейротоксин-гемагглютининовому комплексу, что может явиться причиной вторичной нечувствительности пациентов к повторным инъекциям препарата.
Аминокислотный состав нейротоксина типа А расшифрован, в легкой цепи содержится 448 аминокислот, в тяжелой — 848. Другие серотипы ботулотоксина отличаются количеством и последовательностью аминокислот, главным образом, в легкой цепи.
Принципиальный механизм действия всех типов ботулинических токсинов заключается в пресинаптической блокаде выброса ацетилхолина из нервной терминали периферического холинергического синапса.
Передача нервного импульса в холинергическом синапсе происходит в несколько этапов. В пресинаптической нервной терминали постоянно синтезируется и накапливается ацетилхолин в виде везикул, которые транспортируются к пресинаптической мембране, с тем, чтобы молекула медиатора могла выйти в синаптическую щель и связаться со специфическими холинергическими рецепторами постсинаптической мембраны. На этом участке постсинаптической мембраны возникает мембранный потенциал и происходит сокращение мышечного волокна. Однако процесс транспорта везикул ацетилхолина к пресинаптической мембране происходит не спонтанно, а активно с помощью комплекса особых транспортных белков, главными из которых являются SNAP-25, синтаксин и синаптобревин.
Именно транспортные белки являются мишенью действия ботулинических нейротоксинов. При попадании ботулотоксина в мышцу или другой орган-мишень (с током крови при ботулизме или с лечебной целью при инъекции) молекулы токсинового комплекса достигают нервных терминалей аксонов, прикрепляются к ним, и далее нейротоксиновая часть внедряется в цитозоль нервной терминали, где распадается на короткую и длинную цепи. Короткая цепь (являющаяся цинк-зависимой протеазой) необратимо и специфично расщепляет транспортный белок, тем самым делая невозможным выход ацетилхолина в синаптическую щель и мышечное сокращение.
Эффекты инъекции ботулотоксина и способы их продления
При внутримышечном введении ботулотоксина развиваются два эффекта: прямое ингибирование альфа-мотонейронов на уровне нервно-мышечного синапса и ингибирование гамма-мотонейронного холинергического синапса на интрафузальном волокне. Снижение гамма-активности ведет к расслаблению интрафузальных волокон мышечного веретена и уменьшает активность 1а-афферентов. Это приводит к снижению активности как мышечных рецепторов растяжения, так и эфферентной активности альфа- и гамма-мотонейронов. Клинически это проявляется в выраженном расслаблении инъецированных мышц и значительном уменьшении боли в них.
При локальном введении в терапевтических дозах, ботулотоксин не проникает через гематоэнцефалический барьер и не вызывает существенных системных эффектов. Процесс пресинаптического расщепления транспортных белков ботулотоксином является необратимым и занимает в среднем 30–60 минут, поэтому специфический ботулинический антитоксин эффективен лишь в течение получаса после поступления токсина к органам-мишеням. Несмотря на то, что клеточные эффекты развиваются очень быстро и необратимо, клиническое миорелаксирующее действие препарата после проведенной инъекции начинается проявляться через несколько дней. Однако имеются наблюдения как мгновенного наступления эффекта, так и отсроченного на 3–4 недели.
Через 1–2 месяца после инъекции начинается процесс отрастания новых нервных терминалей от аксонов, где прежде был блокирован транспорт ацетилхолина, с образованием новых функционально активных нервно-мышечных синапсов (спраутинг), что приводит в конечном итоге к восстановлению мышечных сокращений через 3–6 месяцев после инъекции, но иногда длительность эффекта сохраняется до 1 года и более.
Гистологическими исследованиями доказано, что даже после 30 повторных инъекций в одну и ту же мышцу не возникает необратимой деиннервации и атрофий.
Исключительно важной является разработка способов усиления и продления эффекта инъекции, поскольку частые повторные инъекции могут приводить к образованию антител, а также существенно удорожают стоимость лечения. Выявлено, что более стойкие и полные эффекты токсина проявляются при максимальном мышечном сокращении, при достаточной внутриклеточной концентрации ионов кальция (возможно и калия), при воздействии низких температур. Поэтому во время подготовки к лечебной инъекции за 2 недели пациенту рекомендуется назначить прием препаратов кальция и калия с витамином D, непосредственно перед инъекцией и сразу после нее — охлаждать область инъекции, а также интенсивно напрягать инъецируемые мышцы в течение 15–30 минут после процедуры.
Размер поля деиннервации, вызываемой инъекцией токсина, зависит от дозы токсина и объема вводимого раствора. Наилучшие результаты достигаются при равномерном распределении препарата в несколько точек вдоль одной мышцы. Кроме того, более полная блокада нервных терминалей наступает при инъекции токсина вблизи концевых моторных пластинок периферического нерва.
В настоящее время накопились факты, свидетельствующие о том, что эффекты ботулотоксина значительно сложнее и шире, чем временный локальный блок проведения в терминалях альфа-мотонейронов. По-видимому, имеется блокада как интрафузальных, так и экстрафузальных волокон, что может объяснить более широкую зону действия токсина и на терминали чувствительных волокон различной модальности. В частности, это может объяснить быстрый анальгетический эффект инъекции ботулотоксина. За счет механизма деафферентации рецепторов мышечных веретен и других видов чувствительных систем ботулотоксин может оказывать непрямые эффекты на вышележащие отделы центральной нервной системы. При исследовании моторного потенциала выявлено уменьшение латентных периодов его компонентов, снижение активации париетальной коры и каудальной дополнительной моторной области при позитронно-эмиссионной томографии, изменение реципрокного торможения на уровне спинного мозга у больных с постинсультными спастическими парезами.
Методика назначения препаратов ботулотоксина
Следует избегать назначения более чем 300–400 ЕД в течение одной сессии инъекции. К настоящему времени не выявлено серьезных побочных действий препаратов ботулотоксина при применении его в рекомендуемых дозах. Возможно возникновение чрезмерной мышечной слабости, однако со временем происходит восстановление мышечной силы. Может наблюдаться также вторичная резистентность к препарату, для профилактики которой рекомендуют делать интервал между сессиями инъекций не менее 12 недель. Не выявлено также эффекта взаимодействия ботулотоксина и пероральных миорелаксантов центрального действия.
На сегодняшний день широкое применение ботулинотерапии при постинсультной спастичности в значительной степени ограничивается высокой стоимостью препарата. Однако проведенное в Германии исследование по изучению эффективности трех вариантов лечения постинсультной спастичности: физиотерапия, ботулинотерапия + физиотерапия, баклофен + физиотерапия — показало, что снижение спастичности при сочетании ботулотоксина и физиотерапии было в три раза значительнее, чем при использовании баклофена и физиотерапии, и в десять раз больше, чем при применении одной физиотерапии. Оценка показателя стоимость/эффективность лечения постинсультной спастичности была ниже при использовании ботулотоксина и физиотерапии, чем при других методах лечения.
Для более обоснованного назначения препарата O’Brien С. (Muscle and Nerve, 1997) рекомендует придерживаться следующего алгоритма назначения препаратов ботулотоксина при постинсультной спастичности (рис. ниже).
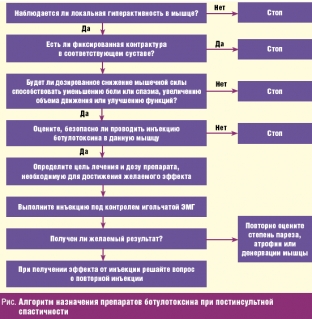
В данном алгоритме С. O’Brien не рекомендует проведение ботулинотерапии при фиксированных контрактурах в суставах. В ситуации фиксированной контрактуры, вызванной укорочением сухожилий или дистрофическими изменениями в самом суставе, введение ботулотоксина приводит к расслаблению спастических мышц, но объем движения в суставе не увеличивается и двигательные функции остаются прежними. Однако, по мнению Е. Д. Белоусовой (Неврологический журнал, 2001), ввиду наличия функционально невыгодной контрактуры (кисти, эквиноварусной деформации стопы), не обеспечивающей работоспособность конечности, выраженного болевого синдрома, введение ботулинического токсина в спастичные мышцы является обоснованным.
В настоящее время расчет дозы препарата ботулотоксина типа А, а также точки его введения в мышцы-мишени при различных проявлениях постинсультной спастичности определяют по рекомендациям Brin M. F. and Spasticity Study Group (табл. ниже).
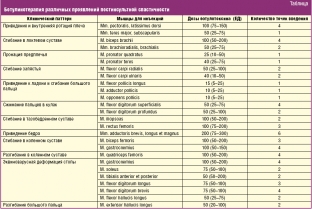
По данным рекомендациям, минимальные дозы нейротоксина вводят при легкой степени спастичности, максимальные дозы — при выраженной степени спастичности и больших размерах мышц. Общая доза препарата не должна превышать 400 ЕД.
У всех пациентов с постинсультными спастическими двигательными расстройствами, в связи с повышением тонуса сгибателей запястья и пальцев рекомендуется обязательное введение ботулотоксина в следующие мышцы: лучевой сгибатель запястья по 20–40 ЕД, локтевой сгибатель запястья по 20–40 ЕД, поверхностный сгибатель пальцев по 20–40 ЕД, глубокий сгибатель пальцев по 30–60 ЕД. Общая доза препарата составляет 75–150 ЕД. Инъекции всех этих мышц (в 1–2 точки) осуществляются при введении инъекционной иглы в поперечном по отношению к предплечью направлению с поэтапным введением препарата в каждую мышцу. В остальные мышцы-мишени верхней конечности введение ботулотоксина зависит от клинического паттерна.
В нижней конечности, в связи с повышением мышечного тонуса в задней группе мышц голени, выясняется, какая из мышц задней группы голени (икроножная или камбаловидная) играет ведущую роль в спастичности. Если высокий тонус в голеностопном суставе (при тыльном сгибании стопы) определяется при разогнутом коленном суставе, но существенно ослабевает при сгибании, то это указывает на ведущую роль икроножной мышцы в спастичности, поскольку при сгибании колена происходит расслабление икроножной мышцы, участвующей как в сгибании колена, так и в подошвенном сгибании голеностопного сустава. В этих случаях вводят 100–150 ЕД ботулотоксина в четыре точки икроножной мышцы (по 25–35 ЕД в каждую точку). В тех случаях, когда спастичность в равной мере вызвана как икроножной, так и камбаловидной, дополнительно, в дозе 50–100 ЕД в две точки (по 25–50 ЕД), препарат вводят в камбаловидную мышцу. Выбор остальных мышц-мишеней ноги также зависит от клинического паттерна [34].
Максимальный эффект после проведения ботулинотерапии отмечается, в среднем, через 2–3 недели после проведения инъекций. Повторное нарастание мышечной спастичности происходит, как правило, через 4–6 месяцев после введения ботулотоксина, что требует повторения процедуры.
В заключение необходимо отметить, что во всех случаях после проведения ботулинотерапии требуется активная физиотерапия и физическая реабилитация. Ботулинотерапия не заменяет физиотерапию и лечебную физкультуру, что составляет основу реабилитационной программы у больных, перенесших мозговой инсульт, а представляет лишь интегральную часть комплексного восстановительного лечения, направленного на улучшения двигательных функций.
Значительное число вопросов, связанных с применением ботулинического токсина при спастичности, требуют дальнейшего изучения. Во-первых, безопасно и эффективно ли использование больших доз ботулотоксина, что часто необходимо при выраженной спастичности во многих мышцах у больных после мозгового инсульта? Во-вторых, в какие сроки с момента инсульта следует проводить ботулинотерапию? В-третьих, каковы оптимальные дозы и точки введения препарата в различные мышцы? В-четвертых, какая комбинация средств медицинской реабилитации и ботулинотерапии оптимальна в различных сроках давности заболевания?
Таким образом, проблема восстановительного лечения постинсультного спастического мышечного гипертонуса с использованием ботулотоксина в течение многих лет занимает одно из важных мест в практической неврологии и нейрореабилитации и требует дальнейшего изучения.
По материалам lvrach.ru







Добавить комментарий