

На сегодняшний день антигистаминные препараты (АГП) являются одними из базовых средств лечения широкого спектра аллергических и воспалительных заболеваний и активно используются врачами в клинической практике. Основными показаниями к назначению АГП служат аллергический риноконъюнктивит, различные виды крапивницы. Эти препараты также активно используются в дерматологии для снижения интенсивности зуда при дерматозах (атопическом дерматите, почесухе, экземе), а также для купирования острых аллергических реакций на пищевые продукты и лекарственные препараты, укусы и ужаления насекомых.
История создания препаратов по борьбе с гистамином
История создания этих препаратов началась в 1910 г., когда был открыт гистамин. Гистамин – физиологический регулятор тканевого и метаболического гомеостаза и одна из наиболее изученных молекул в медицине. Основными депо гистамина в тканях являются тучные клетки, в крови – базофилы.
Гистамин участвует во взаимодействии между цитокинами и воспалительными клетками, способствует миграции клеток в область воспаления.
Гистамин участвует в сложном бинаправленном взаимодействии между цитокинами и воспалительными клетками или их предшественниками, способствует миграции клеток в область воспаления, стимулирует лимфоцитарную активность, регулирует работу эозинофилов, нейтрофилов и тучных клеток и непосредственно участвует в генерации основных аллергических симптомов, таких как насморк, чихание, заложенность носа, кожный зуд, крапивница. Он является ключевым медиатором при всех клинических симптомах аллергии, активизирующим клеточные поверхностные специфические рецепторы.
Может быть интересно Аллергия на косметику и как в ней разобраться
В настоящее время известно 4 типа гистаминовых рецепторов
H1-рецепторы экспрессируются на многих типах клеток, в т. ч. тучных клетках, базофилах, дендритных клетках, эндотелиальных клетках и клетках гладких мышц.
Они играют важную роль в инициировании провоспалительной активности иммунных клеток при их взаимодействии с гистамином и тем самым обусловливают клинические проявления аллергической реакции. Основной целью супрессивной терапии H1-блокаторами является конкурентное ингибирование гистаминовых H1-рецепторов для предупреждения развития инициируемых гистамином эффектов при аллергическом рините (АР), крапивнице и других аллергических процессах.
В исследованиях в последние годы было установлено, что в норме H1-рецепторы представлены в клетках в 2-х состояниях: активном и неактивном.
Гистамин связывается с активными рецепторами и смещает динамическое равновесие в их сторону. АГП стабилизируют H1–рецептор в неактивном состоянии, являясь их обратным агонистом. Таким образом, АГП предупреждают или сводят к минимуму воспалительные реакции, индуцируемые гистамином.
АГП широко используются в клинической практике более 70 лет. Первые АГП были разработаны в 1937 г. французскими учеными A. Staub и D. Bouvet, работавшими в институте Пастера в Париже (Франция). Однако в связи с высокой токсичностью использование данных соединений оказалось невозможным.
В 1942 г. известным французским ученым H. Halpern в клиническую практику были введены фенбензамин, а затем пириламин, относящие к АГП I поколения. Впоследствии было разработано и внедрено в клиническую практику множество препаратов данной группы. В начале 1980-х гг. были разработаны АГП нового поколения. Основное различие между данными 2-мя группами препаратов заключается в наличии или отсутствии у них седативного эффекта. H1-АГП I поколения (седативные) принято называть классическими, а H1-АГП II поколения (неседативные) – современными.
Как в организме человека развиваются аллергические реакции
К H1-АГП I поколения относятся: дифенгидрамин, клемастин, диметинден, хлоропирамин, мебгидролин, хифенадин, гидроксизин и др. АГП I поколения способны проникать через гематоэнцефалический барьер и, следовательно, связываться с H1-рецепторами в головном мозге.
Седативно-снотворное действие при их приеме отмечается у 40–80% больных. Его отсутствие у отдельных пациентов не исключает объективного отрицательного действия этих средств на когнитивные функции (память, способность к обучению, управлению автомобилем).
В связи с неселективностью действия и влиянием на другие рецепторы (М-холинорецепторы, серотониновые, α-адренорецепторы) и ионные каналы АГП I поколения могут вызывать сухость слизистых, дрожь, синусовую тахикардию, задержку мочи, запор, гипотензивный эффект.
Кроме того, высокие дозы некоторых АГП токсичны, особенно для детей. В связи с конкурентным блокированием H1-рецепторов гистамина терапевтический эффект АГП I поколения быстро обратим, что требует применения препаратов данной группы несколько раз в сутки.
Следует также учитывать, что эффективность препаратов в процессе лечения снижается: в 1-ю нед. применения терапевтический эффект есть, на 2-й нед. наступает фаза привыкания, а на 3-й нед. – фаза побочного действия. Следовательно, H1–АГП I поколения нельзя применять более 14 дней.
Несмотря на то, что Н1-АГП I поколения способны вызывать побочные эффекты, перечисленные выше, они и сегодня широко применяются в клинической практике. У Н1-АГП I поколения имеется одно преимущество – наличие инъекционных форм, незаменимых при оказании экстренной помощи, премедикации перед проведением некоторых видов диагностического обследования и хирургических вмешательствах.
В настоящее время накоплен большой клинический опыт применения АГП I поколения, но клинических исследований, соответствующих требованиям доказательной медицины, не проводилось.
Наличие выраженных побочных эффектов Н1-АГП I поколения способствовало разработке АГП II поколения. Основными отличиями Н1-АГП II поколения являются высокая избирательность и специфичность действия, отсутствие седативного эффекта и толерантности к препарату (тахифилаксии).
Современные АГП были синтезированы в течение последних 20 лет путем модификации известных соединений. Поэтому по химической структуре они принадлежат к тем же классам, что и АГП I поколения. АГП II поколения имеют высокое сродство к Н1-гистаминовым рецепторам, характеризуются быстрым началом действия, длительностью эффекта до 24 ч.
Они обладают способностью к селективному воздействию на Н1-рецепторы, будучи антагонистами, переводят их в неактивное состояние, не нарушая их физиологических свойств. Эти препараты не проникают через гематоэнцефалический барьер, поэтому практически не вызывают сонливости.
АГП обладают некоторыми значимыми дополнительными противоаллергическими эффектами:
они стабилизируют мембрану тучных клеток, уменьшают экспрессию молекул адгезии (ICAM-1), подавляют индуцированное эозинофилами высвобождение интерлейкина (ИЛ) -8, гранулоцитарно-макрофагального колониестимулирующего фактора и растворимой ICAM-1 из эпителиальных клеток.
Поэтому они более эффективны, чем АГП I поколения, при проведении долговременной терапии аллергических заболеваний, в генезе которых значительную роль играют медиаторы поздней фазы аллергического воспаления. Доказательная база по эффективности и безопасности АГП II поколения весьма солидна [13].
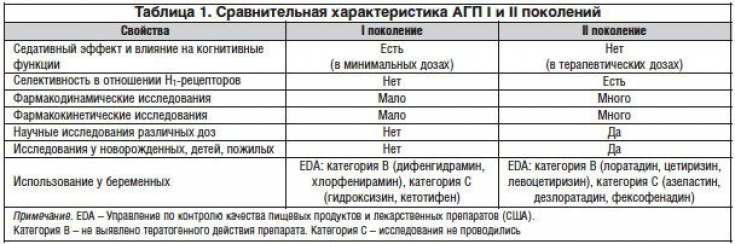
Сравнительная характеристика АГП I и II поколений представлена в таблице 1.
АГП II поколения являются неоднородной группой прежде всего в силу особенностей их метаболизма. Среди них выделяют 2 подгруппы:
- метаболизируемые препараты, которые оказывают терапевтический эффект только после трансформации в печени под воздействием изофермента CYP 3A4 системы цитохрома Р450 с образованием активных соединений. К ним относятся: лоратадин, эбастин, терфенадин, астемизол;
- активные метаболиты – препараты, поступающие в организм в виде активного вещества (цетиризин, левоцетиризин, дезлоратадин, фексофенадин). Обладают более благоприятным профилем безопасности, эффект этих препаратов более предсказуем и не зависит от активности ферментов системы цитохрома Р450, поэтому их применение является более предпочтительным.
Преимущества активных метаболитов, прием которых не сопровождается дополнительной нагрузкой на печень, очевидны: быстрота и предсказуемость развития эффекта, возможность совместного приема с различными лекарственными средствами и пищевыми продуктами, подвергающимися метаболизму с участием цитохрома P450.
Из-за многообразия АГП сделать правильный выбор между тем или иным препаратом достаточно сложно. Эффективность и безопасность нового поколения АГП были продемонстрированы в ходе многочисленных рандомизированных двойных слепых клинических исследований. В клинической практике врач должен ориентироваться на современные данные доказательной медицины, согласно которым H1-АГП II поколения, в частности дезлоратадин, являются препаратами первой линии терапии широкого спектра заболеваний.
Дезлоратадин является активным метаболитом – препаратом, поступающим в организм в виде активного вещества, что обеспечивает его более высокий профиль безопасности.
Он был синтезирован в 1998 г., в России зарегистрирован в 2001 г. Дезлоратадин обладает способностью подавлять острую фазу аллергического ответа за счет блокирования H1-рецепторов. В экспериментальных исследованиях было показано, что дезлоратадин отличается наибольшим сродством к Н1–гистаминовым рецепторам и медленной диссоциацией из связи с ними.
Дезлоратадин неконкурентно связывается с H1-рецепторами и, по данным клинических исследований, обладает в 52, 57, 194 и 153 раза более высокой активностью, чем цетиризин, эбастин, фексофенадин и лоратадин соответственно. Препарат быстро всасывается после приема внутрь и характеризуется большой скоростью достижения максимальной плазменной концентрации и быстрым началом действия (через 1,25–3 ч).
Фармакокинетика дезлоратадина линейна и пропорциональна дозе. Период полувыведения препарата составляет 21–24 ч, что позволяет назначать его 1 р./сут. Прием пищи не оказывает влияния на скорость и степень всасывания препарата. Было выявлено, что фармакокинетика и биодоступность дезлоратадина были сходными при приеме препарата натощак или после стандартизированной пищи у здоровых людей (максимальная концентрация натощак и после еды составила 3,3 и 3,53 нг/мл соответственно, р=0,17). Следовательно, препарат можно принимать как после еды, так и натощак, что свидетельствует об удобстве его применения. Метаболизм и выведение препарата не зависят от возраста и пола больного.
Исследования на животных, in vitro и in vivo продемонстрировали, что дезлоратадин, ингибируя ряд медиаторов воспаления, обладает дополнительными антиаллергическими и противовоспалительными эффектами, не связанными с блокадой Н1-гистаминовых рецепторов.
В физиологической концентрации препарат эффективно угнетает продукцию гистаминзависимых провоспалительных цитокинов – ИЛ-6 и ИЛ-8, которые, как известно, высвобождаясь из эндотелиальных клеток, базофилов и тучных клеток, стимулируют секрецию провоспалительных медиаторов, таких как фактор некроза опухоли-α. Дезлоратадин оказывает влияние на активацию и выживание эозинофилов.
Эозинофилы, являясь ключевыми эффекторными клетками в аллергической реакции, продуцируют цитокины, хемокины, лейкотриены и нейромодуляторы. Кроме того, дезлоратадин за счет обратного агонизма снижает экспрессию ядерного фактора κB (NF-κB), известного в качестве индуктора RANTES, главного аттрактанта для эозинофилов, моноцитов и Т-лимфоцитов, способствующего активации эозинофилов и высвобождению гистамина из базофилов.
Дезлоратадин сильнее других АГП ингибирует активность NF-κB, стимулирующего высвобождение провоспалительных медиаторов из базофилов и тучных клеток. По этому эффекту препарат превосходит цетиризин, лоратадин и фексофенадин. Последние исследования показали, что дезлоратадин может также ингибировать дегрануляцию тучных клеток и последующее высвобождение гистамина. Кроме того, дезлоратадин ингибирует экспрессию Р-селектина, индуцируемую гистамином.
Дезлоратадин характеризуется высоким уровнем безопасности при его применении. Он не вызывает негативных изменений со стороны сердечно-сосудистой системы и других органов, не обладает снотворным действием и не влияет на когнитивные функции. Препарат может применяться пациентами с патологией гепатобилиарной системы и заболеваниями почек, разрешен к применению у детей с 1 года.
В ряду представителей АГП II поколения дезлоратадин выделяется более чем 10-летним успешным опытом широкого медицинского применения и большой доказательной базой. Эффективность и безопасность дезлоратадина в лечении больных хронической идиопатической крапивницей (ХИК) доказаны многочисленными рандомизированными плацебо-контролируемыми клиническими исследованиями (рис. 1).
J. Ring, R. Hein, A. Gauger было проведено двойное слепое плацебо-контролируемое многоцентровое исследование, включавшее 190 пациентов со среднетяжелой и тяжелой ХИК. При обострении заболевания 1-й группе пациентов назначали дезлоратадин 5 мг/сут, 2-й группе – плацебо (контроль). Длительность лечения достигала 6 нед. Первичным критерием эффективности была средняя динамика индекса зуда в течение первых 7 дней лечения по сравнению с исходным показателем. Было выявлено, что в течение 1-й нед. у больных, получавших дезлоратадин, индекс зуда уменьшился на 56%, а в контрольной группе – на 22%, также было отмечено более быстрое регрессирование высыпаний на коже, чем в контрольной группе. Было обнаружено, что у пациентов из 1-й группы в конце 1-й нед. лечения степень нарушения сна при применении препарата уменьшилась на 53%, а у пациентов из 2-й группы – только на 18%. Через 6 нед. на фоне приема препарата индекс зуда уменьшился на 74%, а на фоне приема плацебо – на 48,7%. К концу исследования у пациентов, принимавших дезлоратадин, степень нарушения сна уменьшилась почти на 80%. Как больные, так и врачи высоко оценивали общую положительную динамику симптомов ХИК и ответ на лечение дезлоратадином. Частота нежелательных явлений была сопоставима в 2-х группах, серьезных нежелательных реакций зарегистрировано не было [25].
В более позднем исследовании 137 больных со среднетяжелой и тяжелой формами ХИК были рандомизированы на 2 группы. Пациентам из 1-й группы назначали дезлоратадин 5 мг/сут, из 2-й – плацебо в течение 6 нед. К концу исследования индекс зуда в группе дезлоратадина уменьшился на 1,43, а в группе плацебо – на 0,86 (р=0,004). Через 6 нед. количество больных с полным, значительным или умеренным ответом на лечение было выше в группе больных, получавших дезлоратадин, по сравнению с пациентами, получавшими плацебо (68,8 и 36,8% соответственно). Серьезных нежелательных явлений зарегистрировано не было, а частота любых нежелательных реакций составила 11,1% в группе плацебо и 6,2% в группе дезлоратадина.
В другом исследовании было показано, что дезлоратадин уменьшал выраженность основных клинических симптомов ХИК, прежде всего зуда, на 50–70%. Действие препарата продолжалось до 24 ч. Уменьшение симптомов зуда в конце интервала приема отмечалось у 45% (против 4% принимавших плацебо) и 69% после 6 нед. приема. Также было отмечено достоверное уменьшение размеров и числа пузырей на фоне терапии дезлоратадином при его длительном применении. Пациенты отмечали улучшение сна на 80%. Оценка качества жизни у пациентов с ХИК на фоне приема препарата в течение 7 дней показала снижение баллов по шкале опросника Dermatology Life Quality Index (DLQI) c 13,4 до 9,1. У 60% больных в течение указанного срока индекс DLQI уменьшился в среднем на 2 балла. К концу исследования доля таких пациентов достигла 77% (р<0,0001).
Эффективность и переносимость дезлоратадина у пациентов с аллергическими заболеваниями изучались также в 4-х крупных клинических исследованиях в Германии в 2001–2002 гг. Общее число пациентов обоего пола в возрасте старше 12 лет составило 77 800. Симптомы аллергических заболеваний оценивались до и после лечения. В результате лечения дезлоратадином у подавляющего числа пациентов наблюдалось купирование симптомов, что свидетельствовало о выраженном клиническом эффекте. Причем быстрое начало действия на фоне приема дезлоратадина отметили 67% пациентов и 63% врачей. Помимо купирования основных симптомов аллергических заболеваний у большинства пациентов улучшалось общее состояние в виде нормализации сна и повышения дневной активности.
В клиническом исследовании с включением 12 050 пациентов была подтверждена высокая терапевтическая эффективность дезлоратадина при ХИК. При этом было отмечено, что антигистаминная и антиаллергическая активность препарата не сопровождается эффектом седации и не влияет на когнитивные и психомоторные функции (концентрация внимания, память, способность к обучению). Это позволяет длительно использовать препарат в амбулаторной практике.
В России был проведен ряд исследований эффективности применения дезлоратадина в терапии различных дерматозов, сопровождающихся субъективными ощущениями в виде зуда. Ю.В. Сергеевым и соавт. была оценена эффективность дезлоратадина при лечении 26 детей в возрасте от 5 до 15 лет, страдающих атопическим дерматитом (рис. 2). Длительность заболевания составляла от 4 до 12 лет. Дети до 12 лет получали препарат в сиропе по 2,5 мг в 5 мл 2 р./сут в течение 14 дней. У детей старше 12 лет применялась таблетированная форма по 5 мг/сут.
На время лечения другие лекарственные средства, в т. ч. глюкокортикостероиды, были отменены. Было показано, что через 14 дней после назначения дезлоратадина значительно уменьшились зуд, мокнутие и размеры очагов, снизились индекс SCORAD (в 5 и более раз), а также уровень общего иммуноглобулина (Ig) класса E и частота выявления IgE-антител к пищевым и бытовым аллергенам. В целом практически у 90% детей 2-недельная терапия дезлоратадином способствовала уменьшению зуда или его полному регрессу. Нежелательных побочных реакций отмечено не было.

Изучение эффективности и безопасности дезлоратадина было проведено Н.В. Кунгуровым и соавт. у больных аллергодерматозами. Авторы показали, что при атопическом дерматите и экземе наряду с гистамином пруритогенные эффекты поддерживались повышенным содержанием в организме других биологически активных веществ, таких как серотонин, брадикинин, калликреин, протеазы, простагландины, лейкотриены и эйкозаноиды. Проводимая терапия дезлоратадином по 5 мг/сут в комплексе с наружной негормональной терапией дала положительный эффект в виде уменьшения зуда или его полного регресса у 90% пациентов. Побочных эффектов при проведении лечения дезлоратадином отмечено не было [31].
И.М. Корсунская и соавт. оценивали активность противозудного действия дезлоратадина у больных с фотодерматитом, солнечной экземой, крапивницей, экземой и атопическим дерматитом. Всем больным с острым течением процесса дезлоратадин назначался в дозе 5 мг/сут в течение 2 нед., при хроническом течении продолжительность терапии составляла 3 нед. Во всех случаях проводимое лечение было эффективным, положительный эффект в виде облегчения зуда достигался в течение 3–7 дней терапии. У всех больных с фотодерматитом, солнечной экземой, крапивницей наступило клиническое выздоровление после окончания терапии, у больных с экземой и атопическим дерматитом отмечалось значительное улучшение в виде отсутствия зуда и уменьшения эритемы.
Согласно международным и национальным согласительным документам, в качестве первой линии медикаментозной терапии АР и поллиноза рекомендуется применение неседативных АГП II поколения. Дезлоратадин удовлетворяет всем критериям ARIA/EAACI и рекомендуется в качестве первой линии лечения АР.
В недавно проведенном исследовании в Институте иммунологии изучались эффективность и безопасность (переносимость) дезлоратадина у пациентов с сезонным АР. В исследование были включены 30 пациентов (12 мужчин и 18 женщин) с АР в период обострения, которые в течение 28 дней получали дезлоратадин по 5 мг/сут. Пациенты ежедневно оценивали динамику симптомов АР, а также потребность в топических деконгестантах до начала курса лечения и в период терапии. Все 30 пациентов, получавших препарат, отметили уменьшение выраженности симптомов АР (выделений из носа, стекания слизи по задней стенке глотки, чихания и заложенности носа), а также глазных симптомов (зуда в глазах, слезотечения и покраснения глаз).
Улучшение состояния отмечалось уже к концу 1-й нед. приема, и данная тенденция сохранялась в течение 4 нед. наблюдения. К концу курса лечения полная ремиссия и значительное улучшение отметили 73% больных. Исследования показали, что дезлоратадин является высокоэффективным препаратом в отношении уменьшения выраженности назальных и глазных симптомов у пациентов с сезонным АР и конъюнктивитом.
Он обладает хорошим профилем безопасности, приводит к улучшению качества жизни пациента и может быть рекомендован в качестве монотерапии у больных АР с легким течением заболевания и в комплексной терапии у больных АР со среднетяжелым и тяжелым течением.
При АР в состав комплексной терапии часто включаются назальные деконгестанты для местного применения в виде капель или спрея и аэрозоля. Одним из активно используемых средств в клинической практике является препарат Эвказолин. Основной компонент препарата – ксилометазолин, оказывает сосудосуживающее и противоотечное действие, в результате чего восстанавливается носовое дыхание. За счет входящего в состав эвкалиптового масла препарат обладает противовоспалительным и антимикробным действием.
Препарат оказывает α-адреномиметическое действие, уменьшает гиперемию, экссудацию, облегчает носовое дыхание. Благодаря входящему в его состав эвкалиптовому маслу препарат устраняет сухость слизистой оболочки полости носа и оказывает противовоспалительное и антисептическое действие.
Действует преимущественно местно, при использовании в терапевтических дозах всасывается через слизистые оболочки в незначительном количестве. Действие начинается через несколько минут после применения, длится в течение 8–10 ч. Показания к применению препарата: острый ринит и риносинусит, поллиноз; средний отит (для уменьшения отека слизистой оболочки носоглотки); а также подготовка пациента к диагностическим и лечебным процедурам в носовых ходах.
В России Эвказолин выпускается в форме Эвказолин Аква спрея. Препарат назначают взрослым и детям в возрасте старше 12 лет по 1 впрыскиванию 2–3 р./сут в каждый носовой ход. Продолжительность применения препарата – 5–7 дней.
Таким образом, дезлоратадин может применяться при острых и хронических заболеваниях кожи как в форме монотерапии, так и в составе комплексной терапии. Дезлоратадин имеет наибольшую аффинность к H1-рецептору, медленно диссоциирует, обладает свойствами как нейтрального антагониста, так и обратного агониста и отличается самым продолжительным периодом полураспада по сравнению с другими представителями H1–АГП II поколения. Он не обладает седативным эффектом и не вызывает других побочных реакций, связанных с воздействием на ЦНС. Препарат эффективен в лечении АР, зудящих дерматозов, в частности таких, как атопический дерматит, аллергический контактный дерматит, экзема, крапивница, красный плоский лишай, мастоцитоз, а также при идиопатическом зуде.
Приверженность пациента к определенному виду терапии и к конкретному препарату зависит от эффективности, уровня безопасности, удобства применения и стоимости препарата. Поскольку большинство аллергических заболеваний имеет хронический характер, и пациент оплачивает лечение из своих собственных средств, экономическая доступность лекарственного средства имеет большое значение.
Поэтому помимо оригинального препарата дезлоратадин на фармацевтическом рынке представлен рядом дженериков, стоимость которых ниже. Увеличение ассортимента высокоэффективных и безопасных противоаллергических средств, одним из которых является препарат Элизей (дезлоратадин 5 мг), расширяет выбор больным лекарства по фармакоэкономическим критериям, повышая доступность качественного лечения для большого числа пациентов с аллергическими заболеваниями.
Элизей – блокатор гистаминовых Н1-рецепторов (длительного действия) является первичным активным метаболитом лоратадина. Ингибирует высвобождение гистамина и лейкотриена С4 из тучных клеток. Предупреждает развитие и облегчает течение аллергических реакций.
Обладает противоаллергическим, противозудным и противоэкссудативным действием. Уменьшает проницаемость капилляров, предупреждает развитие отека тканей, снимает спазм гладкой мускулатуры. Практически не обладает седативным эффектом и при приеме в дозе 7,5 мг не влияет на скорость психомоторных реакций. В сравнительных исследованиях дезлоратадина и лоратадина качественных или количественных различий токсичности 2-х препаратов в сопоставимых дозах (с учетом концентрации дезлоратадина) не выявлено.
Элизей применяется для устранения симптомов, связанных со следующими состояниями: АР (чихание, выделения из носа, зуд и заложенность носа, зуд и покраснение глаз, слезотечение, зуд в области неба); крапивница (зуд, сыпь). Препарат применяют внутрь в одно и то же время суток.
Взрослым и детям с 12 лет препарат назначается в дозе 5 мг (1 таблетка) 1 р./сут, независимо от приема пищи. Продолжительность лечения зависит от тяжести и течения заболевания. Лечение интермиттирующего АР (наличие симптомов менее 4 дней в 1 нед. или менее 4 нед.) необходимо проводить с учетом анамнестических и клинических данных: прекратить после исчезновения симптомов и возобновить после повторного их возникновения. При персистирующем АР (наличие симптомов более 4 дней в 1 нед. или более 4 нед.) необходимо продолжать лечение в течение всего периода контакта с аллергеном.
Таким образом, применение АГП эффективно устраняет симптомы аллергических реакций, улучшая качество жизни пациентов.
Аллергены осенью: основные причины возникновения недуга







Добавить комментарий