

Как в современной эстетической медицине выбрать безопасный препарат для контурной пластики, или же «аугментации мягких тканей», именно так в научной медицинской литературе определяется совокупность инъекционных методик, направленных на восстановление или увеличение объема тканей лица, устранение морщин и т.д.?
Специально для читателей estet-portal.com о том, к какой категории медицинских изделий относятся препараты для аугментации мягких тканей, какими нормативными документами это регламентировано и, кто должен следить за безопасностью и качеством данной продукции, рассказал хирург, дерматолог, специалист в области эстетической медицины Владимир Охтень.
- К какой категории медицинских изделий относятся препараты для контурной пластики
- Кто контролирует качество медицинских изделий
- Как медицинское изделие вводится эксплуатацию
- Как на практике врачу определить безопасность используемого препарата
- Почему все эти пункты так важны для безопасности врача
К какой категории медицинских изделий относятся препараты для контурной пластики
В.О.: Препараты для контурной пластики относятся к медицинским изделиям. Для их более конкретной идентификации существует всемирная номенклатура медицинских изделий (GMDN; Global Medical Device Nomenclature), которая представляет собой список видовых (дженериковых) наименований, используемых для идентификации всей продукции, отнесенной к медицинским изделиям.
В 2019 году Министерство экономического развития и торговли Украины приказом от 05.02.2019 г. № 159 утвердило национальный классификатор НКМИ 024: 2019 «Классификатор медицинских изделий», и он гармонизирован с международной номенклатурой медицинских изделий Global Medical Device Nomenclature (GMDN), 2018.
Принципы формирования личного бренда на рынке эстетической медицины
Согласно этой номенклатуре изделия для аугментации мягких тканей классифицированы как Dermal tissue reconstructive material (Материал для коррекции дефектов кожи) и далее в зависимости от материала (бактериального, животного, человеческого, синтетического происхождения) и наличия анестетика.
Кто контролирует качество медицинских изделий
В.О.: Контроль за безопасностью и качеством медицинских изделий в мире осуществляют определенные структуры, наиболее известны такие как:
- Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration, FDA, US FDA),
- Агентство по регулированию лекарственных средств и медицинских изделий (Medicines and Healthcare products Regulatory Agency, MHRA United Kingdom).
В Европейском союзе это Директива о медицинском оборудовании от 14.06.1993 г. 93/42/EEC (Medical Devices Directive – MD Directive, MDD), которую с 25 мая 2017 года заменяет Medical Device Regulation -MDR (в настоящее время производители одобренных медицинских изделий имеют переходный период в три года до 26 мая 2020 года.
Обучение врачей: где получить качественные знания
В Украине с 1 июля 2015 стали обязательными к применению Технические регламенты в сфере медицинских изделий, разработанных на основе соответствующих Директив Европейского Союза.
В частности, оборот и использование инъекционных имплантатов в Украине разрешается в случае подтверждения их соответствия медицинскому техническому регламенту, утвержденному постановлением Кабинета Министров Украины №754 от 02.10.2013 года.
Согласно этому нормативному документу, а именно приложению 2, препараты для аугментации мягких тканей классифицированы как имплантируемые медицинские изделия и в зависимости от степени потенциального риска применения в соответствии с положениями Директивы 93/42 / ЕС от 14 июня 1993 года "Медицинские изделия" и ДСТУ 4388: 2005 "Изделия медицинские. Классификации в зависимости от потенциального риска применения. Общие требования" относятся к III классу.
Как медицинское изделие вводится эксплуатацию
В.О.: Обязательным требованием технических регламентов относительно медицинских изделий является назначение Уполномоченного представителя производителя на территории Украины, в случае, если производитель не является резидентом Украины, а это практически все имеющиеся на рынке препараты.
Для введения в обращение и эксплуатацию медицинских изделий на территории Украины необходимо пройти процедуру оценки соответствия в отношении этих изделий и нанести национальный знак соответствия.
Читайте самые интересные статьи в Telegram!

Перечень назначенных органов по оценке соответствия продукции требованиям Технического регламента относительно медицинских изделий (сейчас этих организаций 11) можно найти на сайте Государственной службы Украины по лекарственным средствам и контролю за наркотиками http://dls.gov.ua.
Как на практике врачу определить безопасность используемого препарата
В.О.: Как это выглядит на практике, какие сведения о препарате для безопасного использования врач должен знать и иметь возможность проверить? Мы можем рассмотреть это на примере такого крупного и известного производителя, как Швейцарская компания TEOXANE Laboratories.
- Производитель: ТЕОКСАН С.А., Рю де Лион, 105, Женева, Швейцария;
- Уполномоченный представитель производителя в Украине: ООО «Леджи груп», 01103, г.Киев, бульвар Дружбы Народов, дом18/7;
- Национальный знак соответствия (утвержден постановлением КМУ от 30.12.2015 г. № 1184 «Об утверждении формы, описания знака соответствия техническим регламентам, правил и условий его нанесения»):

- Код под национальным знаком соответствия: UA.TR.116, является идентификационным номером ООО ««Украинский научный институт сертификации», который проводил оценку соответствия продукции требованиям Технического регламента;
- Сертификат: №PR/692-19, размещенный на официальном сайте ООО ««Украинский научный институт сертификации» https://uni-cert.ua/
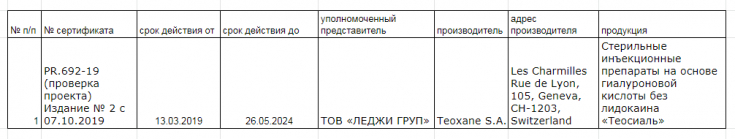
Следует отметить что сейчас в Украине отсутствует единый реестр сертифицированных медицинских изделий, вся информация о сертифицированной продукции находится на официальных сайтах у каждого органа по оценке соответствия отдельно
- Внешняя упаковка и инструкция: должна быть на украинском языке и содержать информацию, указанную в п.1, п.2, п.3, п.4.
Таким образом, мы видим, что продукция компании TEOXANE соответствует всем нормативным документам для ее безопасного использования.
Почему все эти пункты так важны для безопасности врача
В.О.: На сегодняшний день, согласно требованиям действующего законодательства, на уполномоченного представителя производителя возложен ряд обязательств, одним из которых предусмотрено, что он должен немедленно информировать производителя о жалобах и сообщениях от медицинских специалистов, пациентов о подозрительных инцидентах, связанных с медицинским изделием, ведь только производитель может принять решение о дальнейших корректирующих действиях или даже отзыве продукции.
Государственный рыночный надзор и контроль осуществляет «Государственная служба Украины по лекарственным средствам и контролю за наркотиками» проводя плановые и внеплановые проверки характеристик продукции.
Красота с блестящим будущим: секреты идеальной кожи
Так с 2019 года территориальные органы «Гослекслужбы» осуществляют плановые проверки характеристик продукции в сфере обращения медицинских изделий без письменного предупреждения о проведении планового мероприятия субъектов хозяйствования за 10 дней, на основании Закона Украины «О государственном рыночном надзоре и контроле непищевой продукции». Согласно ч. 1 ст. 44 Закона, субъекты хозяйствования за нарушение требований настоящего Закона несут гражданскую, административную или уголовную ответственность.
Выбирая качественный и проверенный продукт – Вы находитесь в правовом поле и гарантируете качество и безопасность контурной пластики своему пациенту.
Больше полезной и интересной информации на нашем канале на YouTube:







Добавить комментарий